Zitat:
Zitat von EMI
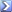
Die Entropie ist eine nicht direkt meßbare Größe.
Man erhält sie durch Integration der aus dem 2. Hauptsatz folgenden Beziehung:
|
Das ist eine mögliche Defintion, es gibt andere.
Normalerweise definiert man die Entropie einfach als Gleichtgewichtsentropie S := -k_B <ln rho>
Dazu braucht man dann auch keine Temperatur wie in deiner Definition, sondern man rechnet nur mit der Verteilungsfunktion rho. Die Frage ist nun aber, ob diese Definition plausibel ist. Dazu benutzt man dann erst einmal das Fundamentalpostulat um zu zeigen, das diese Definition der Entropie damit vereinbar ist (man könnte prinzipiell aber auch den umgekehrten Weg gehen).
Über die Entropie kann man dann allerlei definieren, wie z.B. auch die Temperatur. Dann muß man erst mal testen, ob diese Definition der Temperatur auch dem entspricht, was man gewöhnlich auf dem Thermometer sieht. Und wenn wir da nun den 2. HS als Postulat hineinstecken, dann bekommen wir die Richtung des Zeitpfeils (-> Ansteigen der Entropie mit zunehmender Zeit).
Zitat:
Zitat von EMI
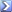
Die verbreiteste Behauptung ist, die Temperatur ist das Maß der Intensität der Bewegung der Moleküle, aus denen sich der Stoff zusammensetzt.
Sprich, die Temperatur ist nur ein anderes Maß für die mittlere kinetische Energie der Moleküle.[/COLOR]
Diese Vorstellung ist falsch.
|
Nein, die ist nicht falsch, sondern einfach nur speziell.
Ganz kurz: Wenn man die Entropie eines idealen klassische Gases in die Def. der Temperatur einsetzt, was bekommt man dann? "E = 3/2 N k_B T". Und was bedeutet das? Ganze einfach: Die Gesamtenergie des Systems ist proportional zur Temperatur und Teilchenzahl. Die Gesamtenergie ist nun aber was? Genau: Die Summe der kinetischen Energien E_kin(n) der einzelnen Teilchen. Und der Mittelwert dieser Teilchenenergien? Ist natürlich "<E_kin> = E/N". Für das gilt nun aber nach der ersten Formel "<E_kin> ~ T".
Damit gilt
für das ideale klassische Gas also auch in der statistischen Physik genau die Vorstellung, das die Temperatur proportional zur mittleren kinetischen Energie der Moleküle ist!
Natürlich gilt das nicht für komplexere Systeme. Der obige Zusammenhang folgt ja aus der Gleichung für die Entropie eines idealen klassischen Gases. Aus dieser Gleichung kann man nun allerlei ableiten und experimentell prüfen (bei Gasen). Und siehe da, das paßt alles sehr gut. Daher ist die Vorstellung des idealen Gases konsistent mit dem Ansatz und damit gilt dann auch für die Temperatur die klassische Vorstellung der mittleren kinetischen Energie.
Nun gilt das natürlich nur, solange man auch Systeme betrachtet, die sich recht gut wie ein ideales klassisches Gas verhalten. Je mehr man davon abweicht, desto weniger stimmt die Vorstellung. Bei Besetzungsinversion kann man so z.B. auch negative Temperaturen bekommen, was ja über die Vorstellung 'mittlere kinetische Energie' im allgemeinen nicht haltbar ist. Aber da haben wird dann eben ein System, welches mit einem idealen Gas nichts mehr zu tun hat.
Nun ist natürlich die Frage, inwieweit es sinnvoll ist, hier jetzt die ganze statistische Physik durchzugehen. Der entscheidende Punkt ist der, das man ohne Statistik nicht weiter kommt. Ohne kann man ja nicht mal die Richtung des Zeitpfeils definieren, weil ja (wie Gandalf schon richtig schrieb) sowohl klassische als auch qm Systeme keine Zeitrichtung auszeichnen (und nein, die CP-Verletzung reicht hier eben nicht). Erst wenn man Systeme aus vielen Teilchen betrachtet, bekommt man die Zeitrichtung, die man auch in der Realität 'sieht', und das schlägt sich im 2. HS nieder, welcher dann (je nach Variante) z.B. sagt, das die Entropie eines abgeschlossenen Systems mit einer Wahrscheinlichkeit, welche durch die Zahl der inneren Freiheitsgrade des Systems gegeben ist, ansteigt.
Gruß, Karsten.