Hallo Jogi
Zitat:
Zitat von Jogi
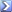
Wird die E.-kin. des Elektrons durch die Coulombkraft erhöht?
Ich dachte immer dass die Elektronen ihre zusätzliche Energie aus dem externen Feld beziehen, wenn eins anliegt.
|
Der Elektronenabstand zum Kern lässt sich über die Schrödingergleichung oder über eine einfache quantenmechanische Rechnung bestimmen, die von der Unschärferelation ausgeht und das Plancksche Wirkungsquant mit der kinetischen Energie verknüpft. Die potentielle Energie nimmt ab, wenn der Abstand r kleiner wird, aber je kleiner r ist, um so grösser ist der vom Unbestimmtheitsprinzip geforderte Impuls, und darum wird auch die kinetische Energie grösser.
E = h²/2ma² - e²/a mit a=Abstand, e=elektr. Elementarladung
Durch Differentation und Gleichsetzung mit null wird a mit 0.528 Ångström aufgelöst.
dE/da=-h²/ma³+e²/a²
Beim Bohrschen Radius findet das Elektron sein Energieminimum.
Zitat:
Wahrscheinlich hab' ich mich falsch ausgedrückt,
ich wollte wissen warum Elektronen bis zu einer gewissen Grenze in höhere Orbitale steigen können,
ohne dem Einflussbereich des Kerns zu entkommen.
Aber das hast du ja weiter oben schon teilweise beantwortet.
Irgendwo ist dann für das einzelne Elektron aber Schluss mit weiterem Aufstieg, dann führt die Absorption weiterer Energie dazu,
dass das E. der Coulombkraft entkommt.
Also scheint die Coulombkraft irgendwo eine scharfe Grenze zu haben,
wo sie nicht mehr mit der E.-kin. der höher angeregten Elektronen fertig wird.
Aber bis dorthin scheint sie so zu wachsen, dass sich ein Gleichgewicht zwischen Fluchtenergie des Elektrons
und Anziehung durch das Proton einstellen kann.
Kann man da für jedes Element ein Grenzorbital angeben?
|
Denk an die Ionisation: Elektronen entfernen sich entsprechend ihrer zugeführten Energie (Anregung) vom Atomkern, so dass das Atom/Molekül als positiv geladenes Ion zurückbleibt. Die Ionisierungsenergie hängt stark von der Anziehungskraft zwischen Atomkern und dem zu entfernenden Elektron ab, welche sich nach der Coulomb-Formel F=k*z/r^2 mit k=Schalenzahl, z=Kernladungszahl, r=Elektronenabstand vom Kern berechnet.
Grüsse, rene